Giuseppe Dalba
In questi appunti vogliamo valutare la frequenza di vibrazione per
una molecola ionica come quella dell'acido cloridrico (![]() ). Per
fare questo è necessario conoscere la forma del potenziale
). Per
fare questo è necessario conoscere la forma del potenziale ![]() di attrazione fra i due atomi di questa molecola, mostrato in figura.
Il potenziale è dato dalla somma di una attrazione coulombiana e
di una repulsione che si manifesta a piccole distanze.
di attrazione fra i due atomi di questa molecola, mostrato in figura.
Il potenziale è dato dalla somma di una attrazione coulombiana e
di una repulsione che si manifesta a piccole distanze.
![\includegraphics[width=.9\linewidth]{potenziale.eps}](img3.png)
|
![\begin{displaymath}
V(r) =
- \underbrace{\frac{e^2}{4\pi\varepsilon_0r}}
_{\p...
... _{\parbox[c]{4em}{\centering \mbox{Forza} \mbox{repulsiva}}}
\end{displaymath}](img4.png)
|
Chiamiamo ![]() la distanza per cui il potenziale è minimo, ovvero
la distanza per cui il potenziale è minimo, ovvero
![]() , e determiniamo il parametro libero
, e determiniamo il parametro libero ![]() in funzione di
in funzione di ![]() :
:
Per piccoli spostamenti attorno a questa posizione di equilibrio
ovviamente il sistema si comporta come un oscillatore armonico,
la cui costante elastica è
![]() :
:
dove nell'ultima espressione ![]() si intende misurato in metri.
Quindi vediamo che
si intende misurato in metri.
Quindi vediamo che ![]() dipende solamente dalla lunghezza di legame
della molecola,
dipende solamente dalla lunghezza di legame
della molecola, ![]() , che si può dedurre da misure sullo spettro
rotazionale. Per
, che si può dedurre da misure sullo spettro
rotazionale. Per ![]() si ottiene questo valore:
si ottiene questo valore:
La costante elastica di legame ionico (fra il Cl![]() ed
il H
ed
il H![]() ) non è quindi qualcosa di fuori dall'ordinario.
Per ricavare la frequenza di vibrazione dobbiamo calcolare
la massa ridotta del sistema, tenendo presente che
) non è quindi qualcosa di fuori dall'ordinario.
Per ricavare la frequenza di vibrazione dobbiamo calcolare
la massa ridotta del sistema, tenendo presente che
![]() e che la massa dell'idrogeno è
e che la massa dell'idrogeno è
![]() Kg:
Kg:
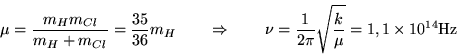
Dunque, siccome la molecola di ![]() ha un momento di dipolo elettrico
che varia con la sua lunghezza
ha un momento di dipolo elettrico
che varia con la sua lunghezza ![]() , dovremmo attenderci che quando
vibra emetta luce a circa
, dovremmo attenderci che quando
vibra emetta luce a circa ![]() Hz, che si trova nella regione
infrarossa dello spettro.
Hz, che si trova nella regione
infrarossa dello spettro.