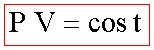
Leggi dei Gas
Legge di Boyle (1662) e Mariotte
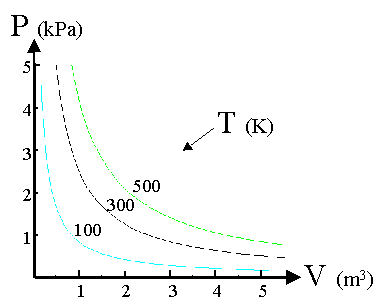
A T=cost la P ed il volume di un gas rarefatto soddisfano la legge:
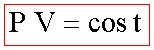
dove il valore della cost dipende oltre che dalla temperatura, dalla natura e dalla massa del gas. Questa legge descrive tanto meglio il comportamento di un gas reale quanto più questo è rarefatto. Un ipotetico gas che obbedisca esattamente alla legge di Boyle e Mariotte, viene detto gas ideale o perfetto.
|
La legge di Gay-Lussac: V = V(T)
A P=cost il volume V e la temperatura T di una data massa di un gas rarefatto soddisfano la legge:
![]()
Dove V0 rappresenta il volume del gas a T = 0°C e a = 1/273.16 °C-1. Il volume di un gas di una data massa, a P = cost è proporzionale alla T.
|
|
La legge di Charles
A V = cost la P e la T di un gas rarefatto soddisfano la legge:
![]()
Dove P0 rappresenta la pressione del gas a T = 0 °C e b = 1/273.16 °C-1. A volume costante, la pressione di una determinata quantità di gas è proporzionale alla temperatura. Le diverse curve si riferiscono a diversi valori di volume, V1 > V2 per una stessa massa di gas.
|
|
Le superfici P -V - T di un gas perfetto
La legge di Avogadro (1811)
Volumi eguali di gas diversi, a parità di pressione e temperatura, contengono lo stesso numero di molecole.
Numero di Avogadro NA = 6.03 1023 è il numero di atomi contenuti in 1 g di idrogeno. NA costituisce il legame tra la macrofisica e la microfisica permettendo si calcolare le masse degli atomi in unità di massa e non solo in termini relativi.
1 mole = quantità di materia contenente un numero di oggetti uguale al numero di Avogadro.
Grammomolecola = massa in grammi di una mole di oggetti
La massa di 1 mole di
H contiene NA atomi di H e pesa 1 g
La massa di 1 mole di H2 contiene 2 NA atomi di H e pesa
2 g
La massa di 1 mole di O2 contiene NA molecole di O2
e pesa 32 g questo perchè una molecola di ossigeno pesa 32 volte il peso di
un atomo di H.

Numero di moli n = N / NA, dove N è il numero di molecole M = massa molecolare.
Dalle leggi di Boyle-Mariotte, Gay-Lussac e Avogadro alla legge dei gas perfetti
Le leggi di Boyle e Mariotte e di Gay-Lussac possono essere compendiate in un’unica relazione che lega P, V, T di uno stato di equilibrio di un gas ideale.
Consideriamo 3 stati di equilibrio di un gas ideale:
|
|
A e B
: T = cost = 0
°C ![]() PV1
= PV0 , da cui:
PV1
= PV0 , da cui:
![]()
B e C:
P = cost ![]() V = V1 (1 + a
t)
V = V1 (1 + a
t)
sostituendo V1 si trova: PV = P0V0 (1 + a t) da cui si ha
![]()
dove T = t + 273.15 è la temperatura assoluta. Ponendo V0 = n v0 dove v0 è il volume di una mole di gas a 0 °C e a P0 = 1 atm, e indicando con R = P0v0/273.15, si ottiene la legge dei gas perfetti:
PV = n R T
Legge di Dalton
In una miscela di due o più gas, perfetti o non perfetti, che non reagiscono tra loro, ciascun componente esercita una pressione parziale uguale a quella che eserciterebbe se occupasse da solo tutto il volume a disposizione.
|
|
Apparecchio
per la verifica della legge di Dalton. I due recipienti all’inizio
(a) contengono gas perfetti diversi nelle stesse condizioni di P e V.
Aperto il rubinetto R (b) i gas si mescolano. La pressione nei due recipienti
resta uguale a P anche quando il volume a disposizione dei due gas raddoppia.
Ciascun gas esercita la pressione P/2 dove:
P = r g h r è la densità del mercurio L'aria è composta dal 78% di azoto, dal 21% di ossigeno e da piccole quantità di altri gas come anidride carbonica, vapor acqueo e gas nobili. La pressione dell'aria è la somma delle pressioni parziali esercitata da ciascuno dei gas che la compongono. Questi si comportano come se occupassero da soli un dato volume, si ha cioè che la pressione parziale di un gas non influisce su quella di un altro. |