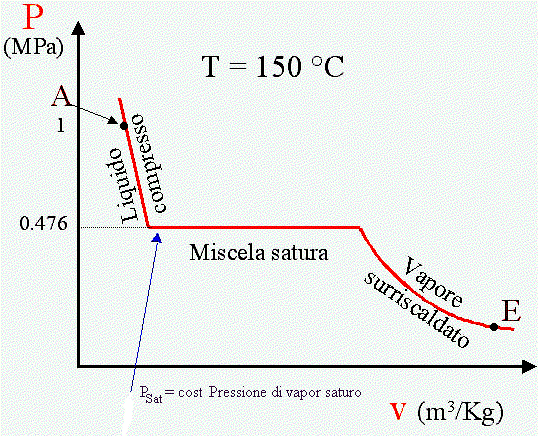
I diagrammi P -V

|
|
|
Fig. 1 Diagramma P-v dell'acqua a temperatura costante
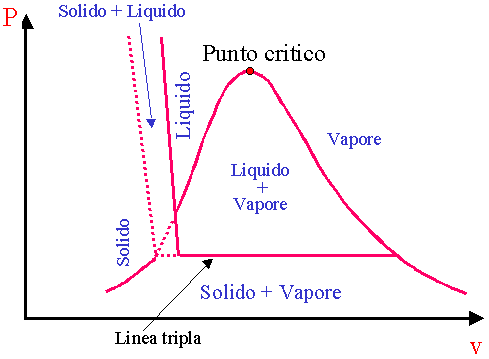
Diagramma P-V includente la fase solida
Diagramma P - Vdi una sostanza che congelandosi si contrae, Es.: H2O
Il fatto che che l’acqua congelando si espande ha conseguenze vitali per la vita sulla terra. Se, al contrario si contraesse, come fanno la maggior parte delle sostanze, il ghiaccio che si forma avrebbe una densità maggiore dell’acqua liquida e si disporrebbe sul fondo dei fiumi, dei laghi e degli oceani invece di galleggiare in superficie. I raggi del sole non sarebbero in grado di riscaldare questi strati di ghiaccio che rimarrebbero sul fondo tutto l’anno distruggendo irrimediabilmente la vita marina.
Linea tripla - punto triplo
|
|
In certe condizioni tutte e tre le fasi di una sostanza pura coesistono in equilibrio. Sui diagrammi P-v e T-v questi stati a tripla fase formano una linea detta linea tripla. Gli stati su una linea tripla hanno la stessa pressione e la stessa temperatura ma diversi volumi specifici. Sui digrammi P-T la linea tripla appare come un punto, il punto triplo. La T e la P del punto triplo variano da sostanza a sostanza. Per l’acqua, Tpunto critico=0.01 °C e Ppunto critico = 0.6113 k Pa |