|
Diagrammi P-T
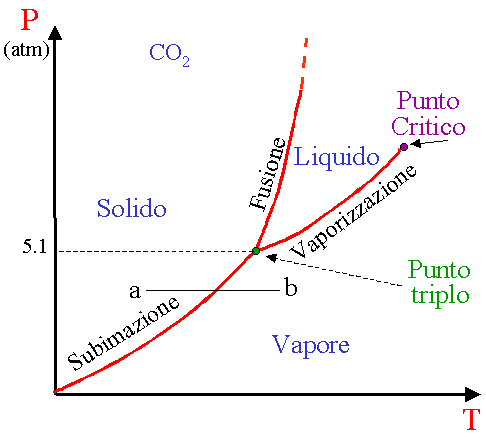
Diagramma per una sostanza che congelandosi si contrae. In figura è rappresentato il diagramma P-T dell'anidride carbonica.

|
Questo tipo di diagramma appartiene ad una sostanza che congelandosi si contrae, come ad es. la CO2.
I diagrammi P-T vengono detti anche diagrammi di fase perché le
tre fasi sono separate tra loro da tre linee. Queste si incontrano in un punto
detto punto triplo in cui le tre fasi coesistono in equilibrio. La linea di
vaporizzazione termina al punto critico perché al di sopra di questo non vi
è distinzione tra fase vapore e fase liquida.
Un solido, non necessariamente passa attraverso lo stato liquido per diventare
vapore (trasformazione ab). Per es. l’anidride carbonica solida (ghiaccio
secco), a pressione atmosferica, sublima perché il suo punto critico si trova
a 5.1 atm. .
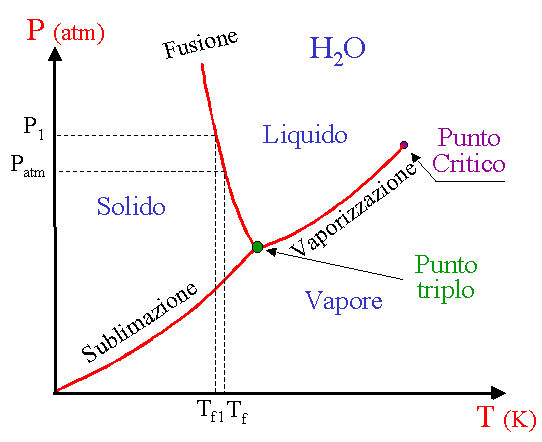
Diagramma P-T dell'acqua
Per una sostanza che congelandosi si dilata
|
Questo tipo di diagramma appartiene ad una sostanza che congelandosi si contrae, come ad es. l’acqua. La curva di equilibrio solido vapore passa per l’origine, il che significa che, allo zero assoluto una sostanza è allo stato solido a qualsiasi pressione.
![]()
A pressioni P1 superiori alla pressione atmosferica la di fusione dell’acqua Tf1 è inferiore a zero gradi Celsius (Tf).
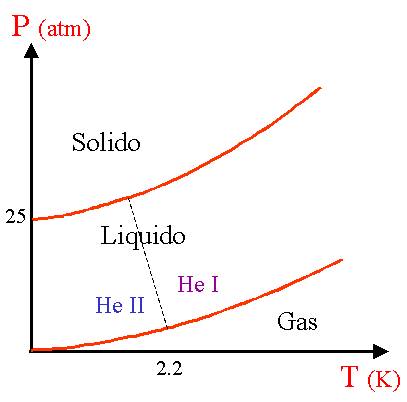
Diagramma PT dell’elio
|
Questo diagramma
di fase non presenta alcun punto triplo! La linea di fusione e quella di evaporazione
non si intersecano. L’elio liquefatto rimane liquido a tutte le temperature
sino a 0 K. Per solidificare l’elio non basta solo raffreddarlo occorre
anche portarlo ad una pressione di almeno 25 atm. A 2.2 K l’elio subisce
una transizione di fase liquido - liquido e passa da da He I ad He II, o viceversa,
acquistando fondamentalmente nuove proprietà.
La linea tratteggiata separa le regioni di esistenza delle due fasi.