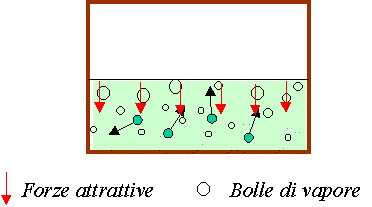
Ebollizione
Vaporizzazione all’interno di una massa di liquido con la formazione di bolle gassose che si rompono in superficie
Evaporazione
Vaporizzazione a livello della superficie del liquido (menisco)
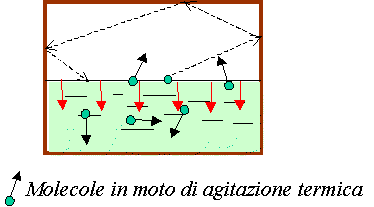
Vaporizzazione
Per vaporizzazione si intende il passaggio di un sistema dallo stato liquido a quello gassoso. Il fenomeno inverso si chiama liquefazione o condensazione
|
Ebollizione Vaporizzazione all’interno di una massa di liquido con la formazione di bolle gassose che si rompono in superficie
|
|
Evaporazione Vaporizzazione a livello della superficie del liquido (menisco)
|
La vaporizzazione è accompagnata da un assorbimento di calore
Temperatura di saturazione e pressione di saturazione
La temperatura a cui l’acqua bolle dipende dalla pressione: se la pressione è fissata lo è anche la temperatura di ebollizione.
Alla pressione atmserica, P = 101.3 kPa, l’acqua bolle a 100 °C; a temperatura ambiente, T=25 °C, l’acqua bolle alla P = 3.17 kPa.
Temperatura di saturazione,
Tsat , è la temperatura a cui una sostanza cambia
di fase ad una data pressione.
Pressione
di saturazione, PSat,è
la pressione a cui una sostanza cambia di fase ad una data temperatura.
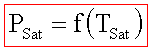
|
T (°C) |
-10 | -5 | 0 | 5 | 10 | 15 | 20 |
|
PSat (kPa) |
0.26 | 0.40 | 0.61 | 0.87 | 1.23 | 1.71 | 2.34 |
|
T (°C) |
25 | 30 | 40 | 50 | 100 | 150 | 200 | 250 | 300 |
|
PSat (kPa) |
3.17 | 4.25 | 7.38 | 12.35 | 101.3 | 475.8 | 1554 | 3973 | 8581 |
Pressione di saturazione dell’acqua a varie temperature, (pressione a cui l’acqua cambia fase: bolle o condensa).
Curve di saturazione liquido - vapore
Ad
alte pressioni P una sostanza bollirà a temperature T più alte.
Alte T di ebollizione
dell’acqua implicano tempi di cottura più brevi e risparmio di energia.
La pressione atmosferica, e così la temperatura di ebollizione dell’acqua,
diminuiscono con l’altitudine, per es. a 2000 m, P = 79.5 kPa che corrisponde
alla TSat = 93.2 °C. Ogni 1000 m Tsat diminuisce di poco
più di 3 °C.
|
|
|
Raffreddamento di alimenti sotto vuoto La Psat dell’acqua a 0 °C è di 0.61 kPa. Congelamento sotto vuoto Si ha congelamento sotto vuoto se la pressione nella camera da vuoto è inferiore a 0.6 kPa che è la PSat dell’acqua a 0°C. |
|
Tabella di Mollier
Le tabelle di Mollier
sono tabelle che riportano i valori del volume molare di liquido saturo vl,
del volume molare di vapor saturo vg, del calore latente
di fusione di fusione e di evaporazione delle sostanze pure.
Pressione di vapore dell’acqua a temperature tra 0 e 374.1 °C. I volumi
vl e vg si riferiscono ad una mole di
acqua.
|
T |
PSat |
PSat |
vl |
vg |
| 0 | 0.61 | 0.00626 | 0.0179 | 3700 |
| 5 | 0.87 | 0.00626 | 0.0179 | 2640 |
| 10 | 1.23 | 0.0121 | 0.0179 | 1910 |
| 15 | 1.70 | 0.0168 | 0.0179 | 1400 |
| 20 | 2.33 | 0.0230 | 0.0179 | 1004 |
| 30 | 4.23 | 0.0418 | 0.0180 | 590 |
| 40 | 7.37 | 0.0728 | 0.0180 | 350 |
| 60 | 19.85 | 0.196 | 0.0183 | 138 |
| 80 | 47.2 | 0.466 | 0.0185 | 61.1 |
| 100 | 101.3 | 1.00 | 0.0187 | 30.0 |
| 150 | 475.8 | 4.69 | 0.0196 | 7.04 |
| 200 | 1554 | 15.3 | 0.207 | 2.28 |
| 250 | 3973 | 39.2 | 0.0224 | 0.897 |
| 300 | 8581 | 84.8 | 0.0252 | 0.389 |
| 374.1 | 22113.8 | 218.3 | 0.057 | 0.057 |
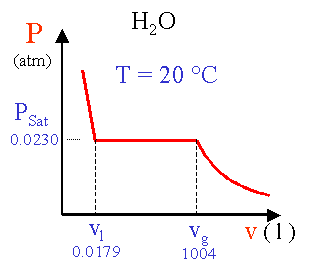
Pressione di vapore
La pressione pSat
del tratto orizzontale di un’isoterma è detta pressione di vapore:
si tratta della
pressione a cui liquido e vapore
coesistono alla temperatura dell’isoterma.
Dai dati riportati nella tabella precedente si ricava che a T = 20 °C una mole
di acqua liquida ha un volume vl = 0.0179 l . Se la stessa quantità
d’acqua viene posta a T = 20 °C in un contenitore di 2 litri, parte del
liquido evapora e va a riempire la parte vuota del contenitore. Quando la pressione
nel contenitore raggiunge la pressione di vapor saturo a T = 20 °C, PSat
= 0.0230 atm (vedi tabella), l’evaporazione cessa: si stabilisce un equilibrio
dinamico per il quale numero di molecole che abbandona il liquido è uguale in
media al numero di quelle che vi rientrano.
All’equilibrio il vapore nel contenitore occupa il volume
![]()
Sempre dalla stessa tabella si trova che 1 mole gassosa di H2O a 20 °C e a Psat=0.0230 atm occupa vg = 1004 l. Il rapporto fra il volume occupato dal vapore ed il volume del vapor saturo vg da’ il numero di moli in fase vapore:
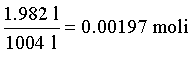
la differenza, 1 -
0.00197 = 0.99803 moli, è la quantità d’acqua allo stato liquido. Se il
volume del contenitore fosse aumentato a tre litri, evaporerebbe altro liquido
per riportare la pressione al valore PSat = 0.0230 atm. Aumentando
ancora il volume del contenitore a 1004 l tutto il liquido si trasformerebbe
in vapore. Un ulteriore aumento di volume comporterebbe una riduzione di pressione
perché il numero di molecole allo stato gassoso non può più aumentare.
La pressione di
vapore è la pressione massima che il vapore può assumere ad una data temperatura.