
Calore
Il calore è quel tipo di energia che viene scambiata fra corpi in contatto a temperatura diversa o in transizioni di fase.
Il calore trasferito ad un sistema, attraversata la superficie di contorno che separa il sistema dall’ambiente, si trasforma in energia accumulata.
Un sistema non accumula calore ma accumula energia interna!

Quantità di calore = Energia trasferita da un corpo più caldo ad uno più freddo a seguito della differenza di temperatura senza che, necessariamente sia fatto del lavoro.
Esistono tre modi di trasferimento del calore:
|
Conduzione |
Definizione operativa del calore
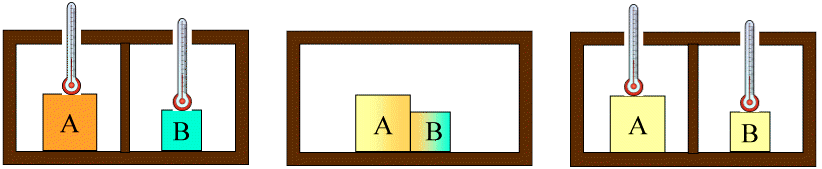
![]()
Consideriamo due corpi a tempature iniziali non molto diverse tra loro.
![]() si ha che
si ha che ![]() ,
da cui:
,
da cui:
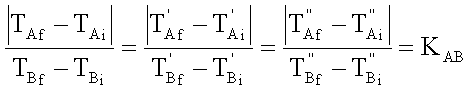
|
KAB è indipendente da TAi e TBi |
KAB dipende da una grandezza caratteristica di ciascuno dei corpi detta capacità termica. Indicando con CA quella del corpo A e con è CB quella del corpo B: |
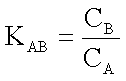
|
|
|
|
|
In generale Q > 0 se la temperatura finale del sistema è maggiore di quella iniziale.
|
|
C = Capacità termica del sistema Tf - Ti = variazione di temperatura del sistema
|
Convenzione sul segno del calore:
|
Analogia : depositi e prelievi da un conto corrente bancario |

(Deposito º calore che entra; Sistema º Conto Corrente; Prelievo calore che esce ) |
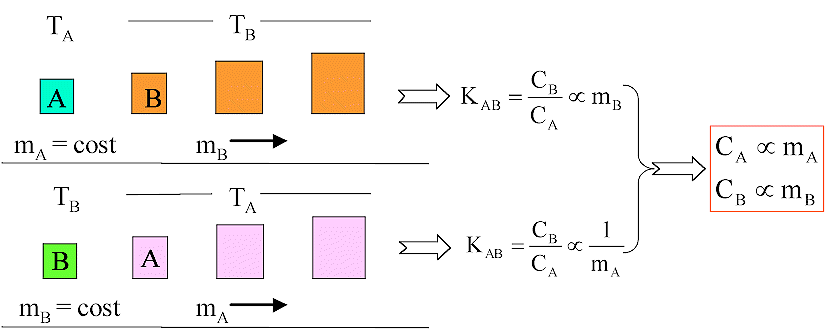
Dipendenza della capacità termica dalla massa m dei corpi
UNITÀ DI CALORE
Storicamente, per definire l'unità si misura del calore si è scelta come sostanza campione l'acqua. L'unità di calore, denominara caloria, è quella quantità di calore necessaria per aumentare la temperatura di 1 grammo di acqua da 14.5 a 15.5 °C.
| Sostanza campione A : Acqua , |
|
cA = Calore specifico dell’acqua |
QA = cA ( Tf - Ti ) = 1 cal per Tf = 15.5 °C e Ti = 14.5 °C e per P = 1 atm.
Per il generico corpo B
CB = KAB·CA = KAB ·mA ·cA,
Come abbiamo visto KAB si determina sperimentalmente da misure di
variazioni di temperatura; indicando con c il calore specifico del generico
corpo B e ponendo C = CB ed m = mB si ha :
C = m.c
La capacità
termica di un corpo è uguale al prodotto fra la sua massa ed il suo calore specifico.
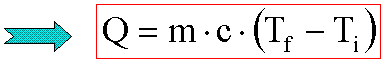
|
( Cal ) o, nel SI, (J) |
Capacità termica
La capacità termica definita attraverso la relazione Q = C (Tf-Ti):
|
|
|
La capacità termica è la quantità di calore che un corpo scambia con l'ambiente quando la sua temperatura cambia di 1 grado. Si definisce calore specifico la capacità termica per unità di massa.
Di fatto C è una capacità termica media relativa all’intervallo di temperatura DT; il suo valore dipende, oltre che da DT, anche dalla temperatura del sistema.
![]() ,
valor medio
,
valor medio
La definizione di capacità termica, ad una data temperatura è:
|
|
(Cal/°C) e nel SI (J/K) ) |
| |
non rappresenta la derivata di Q rispetto a T perché Q non è una proprietà del sistema e non è funzione di T ! |
|
|
piccola quantità di calore scambiata dal sistema in conseguenza della variazione infinitesima di temperatura dT. |
Il calore scambiato in un processo non è completamente definito dalla differenza di T fra lo stato iniziale e finale; per un dato dT si ha che, a seconda del processo:
![]()
Riserva di calore
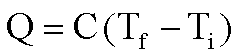
Più grande è la capacità termica di un sistema e minore è la sua variazione di temperatura conseguente ad un dato flusso di calore.
Riserva di calore = sistema a capacità termica infinitamente alta
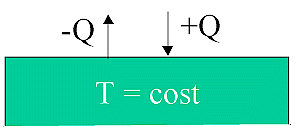
|
La
T di una riserva di calore non cambia per quanto grande possa essere
il flusso di calore Q in uscita o in entrata.
Riserva di calore, sorgente ideale di calore e termostato sono sinonimi |
Il concetto di riserva di calore è un’astrazione utilissima dal punto di vista teorico.
|
Esempi di sistemi che possono ritenersi con buona approssimazione delle riserve di calore: l’atmosfera, il suolo terrestre, un oceano, un fiume, un lago. |

|
Calore associato a cambiamenti di fase
|
|
|
|
| Dopo aver immerso il sistema B in A, la T di A diminuisce e quella di B resta uguale a zero mentre del ghiaccio fonde. Del calore scorre dal A a B. |
QA
= CA ( TAf - Tai )![]()
Il sistema B assorbe
calore senza che la sua T cambi, purché in esso sia ancora presente del ghiaccio.
Il calore QB = |QA|
assorbito da B è proporzionale alla quantità di ghiaccio fuso Dm
= mi - mf ; esso vale:
QB =
l · Dm.
Dove l è il calore
latente di fusione del ghiaccio (g/cm3).
Calore latente
Per produrre una transizione di fase è necessario fornire calore. La quantità di calore dipende dalla sostanza, dalla pressione e dal tipo di transizione di fase. Esso è detto calore latente perché non si manifesta attraverso variazioni di T.
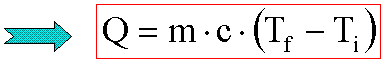
Calore
latente di fusione lf
quantità
di calore necessaria a
fondere 1 g di ghiaccio
lf
=
80 cal/g
Calore
latente di evaporazione = quantità
di calore necessaria a evaporare 1 g di acqua
le
=
540 cal/g
Per una massa m il calore di fusione è Qf = m l f e quello di evaporazione Qe = m le