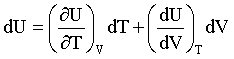
Calori specifici delle sostanze reali
L'energia interna delle sostanze reali, in generale dipende dalla temperatura e dal volume: U = U(T,V).
Il differenziale totale della funzione a due variabili U = U(T,V) è:
|
|
(1) |
Per il primo principio della termodinamica,
|
|
(2) |
Sostituendo l'eq. 1 nell'eq. 2 si ottiene:
|
|
(3) |
A
pressione costante
l'eq. 2 diventa:
![]()
che sostituita nell'eq. 3 da':
|
|
(6) |
Dividendo l'eq. 6 per dTP e ponendo
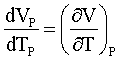
si ha:
|
|
(7) |
Nota l’equazione di stato della sostanza reale f(n, P, T, V) = 0 e l’equazione dell’energia interna U = U(T,V), tutte le quantità a secondo membro dell'eq. 7 possono essere calcolate. L'eq. 7 consente così di determinare CV una volta che CP sia stato determinato sperimentalmente.
Se la sostanza è un gas ideale, ricordando che l'equazione di stato è: P V = n R T e che U=U(T), si ritrova facilmente la relazione di Mayer: CP - CV = R.