Primo
Principio
Lavoro
dissipativo
Un primo esempio di lavoro dissipativo:
agitazione di un fluido tramite una ventola (Fig. 1), o di una sostanza tramite
un frullatore .
|
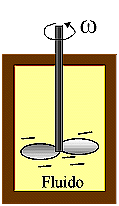 Fig.1 Fig.1
|
Il Lavoro L è
dato da:
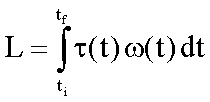
dove
t(t)
è la coppia esercitata dall'esterno sull’asse del frullatore;
w(t)
la velocità angolare di rotazione dell’asse del frullatore
e .
tf - ti la durata dell’agitazione del fluido.
Il
lavoro è sempre negativo indipendentemente dalla direzione di rotazione
del frullatore, cioè è sempre eseguito sul sistema.
|
Un altro caso di lavoro dissipativo è quello di un circuito elettrico resistivo.
|
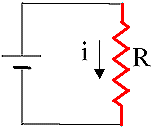 Fig.
2 Fig.
2
|
Al
passaggio della corrente elettrica, i, nella R resistenza elettrica
(sistema), questa si scalda. Il
Lavoro L è dato da:
.
Indipendentemente
dalla direzione della corrente il lavoro è sempre negativo cioè è
sempre eseguito sul sistema.
|
A differenza del lavoro
di configurazione, il lavoro dissipativo non può essere espresso in termini
di una variazione di una qualche proprietà del sistema su cui il lavoro viene
eseguito.
Lavoro
di configurazione, lavoro dissipativo e reversibilità
 |
Il lavoro di configurazione può essere sia subito che eseguito
dal sistema
|
 |
Il lavoro dissipativo viene solo subito dal dal sistema
|
In generale,
in una trasformazione termodinamica si ha che:
Lavoro
totale = lavoro di configurazione + lavoro dissipativo
É bene
ricordare a questo punto quando una trasformazione si dice reversibile. Una
trasformazione è reversibile se è quasistatica e se non vi è lavoro dissipativo.
Non basta la sola condizione di quasistaticià; anche una trasformazione lentissima
può essere irreversibile. Si pensi, per esempio all'espansione termica di un
gas in un cilindro con pistone; è facile realizzare questo processo in maniera
quasistatica riducendo di quantità infinitesime, la pressione sul pistone, non
è altrettanto facile ridurre a zero l'attrito fra pistone ed cilindro.
L'attrito esiste anche quando il pistone va pianissimo tant'è che, in presenza
di una forza, si manifesta persino se il pistone è fermo (attrito statico).
Una forza di attrito dissipa energia.
Un altro esempio può essere la magnetizzazione di un nucleo di ferro.Ricordiamo
brevemente il fenomeno. Inserendo un nucleo di ferro in un solenoide e aumentando
la corrente nel solenoide, il nucleo si magnetizza. La magnetizzazione è dovuta
al campo magnetico presente all'interno del solenoide. A livello microscopico
il fenomeno si interpreta dicendo che i domini magnetici presenti nel nucleo
si orientano preferibilmente nella direzione del campo magnetico. Riducendo
però a zero il campo, nel nucleo persiste una magnetizzazione residua. Per riportare
il sistema allo stato iniziale occorre generare un campo magnetico opposto.
Processi continui di magnetizzazione e smagnetizzazione causano un sensibile
riscaldamento del nucleo di ferro provocato dall'attito tra domini magnetici
contigui nel loro moto di orientazione nel campo magnetico. Per quanto lento
sia il flusso di corrente, il riscaldamento si manifesta in ogni caso.
|
REVERSIBILITA'
Condizioni necessarie e sufficienti affinchè un processo sia reversibile:
-
Il
processo sia quasistatico
-
Il
lavoro dissipativo sia nullo
|
In un processo reversibile
il lavoro totale è solo lavoro di configurazione.
Lavoro
adiabatico
Facciamo
alcuni esempi di trasformazioni adiabatiche; in tutti questi casi immagineremo
il sistema isolato dall'ambiente per messo di una parete isolante o adiabatica:
 Fig.
3
Fig.
3
In Fig. 4 è riportato il
caso di una espansione adiabatica reversibile: la pressione del fluido è la
stessa della pressione esterna Pe a meno di una quantità infinitesima.
In Fig. 5 è riportato il caso di una espansione adiabatica irreversibile, la
cosiddetta espansione libera.
|
Espansione
adiabatica reversibile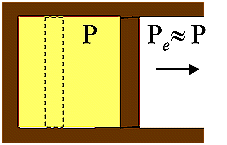
Fig. 4
|
Espansione
adiabatica libera
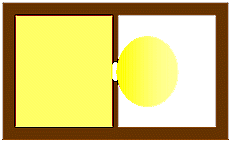 Fig.
5 Fig.
5
|
Altri esempi di trasformazioni adiabatiche:
|
Trasferimento
adiabatico irreversibile di energia meccanica
 Fig.
6 Fig.
6
|
Lavoro
di polarizzazione di un materiale paramagnetico
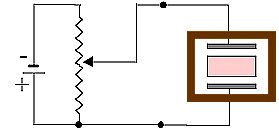 Fig.
7 Fig.
7
|
|
Lavoro
di magnetizzazione di un materiale paramagnetico
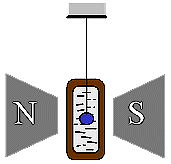 Fig.
8 Fig.
8
|
Trasferimento
adiabatico di energia elettrica
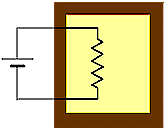 Fig.
9 Fig.
9
|
Dal
lavoro adiabatico al primo principio della Termodinamica
Consideriamo
un sistema termicamente
isolato che passi
da uno stato iniziale
i ad
uno stato finale
f seguendo
differenti cammini. Il sistema può subire processi adiabatici reversibili e
irreversibili, come pure può assorbire lavoro dissipativo dall’esterno.
Consideriamo due esempi:
|
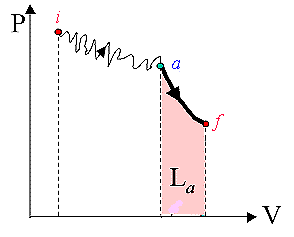 Fig.
10 Fig.
10
|
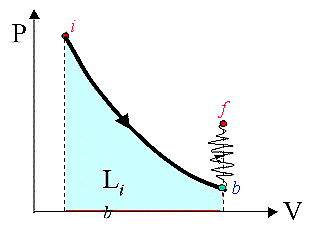
Fig. 11 |
Primo caso
in figura 10: i-a,
espansione
libera, Li a = 0; a-f, espansione adiabatica reversibile,
La f >0: Li a f = La f
Secondo
caso in figura 11: i-b,
adiabatica
reversibile, Li b > 0; b-f riscaldamento isocoro
irreversibile (eseguito tramite una resistenza elettrica o un frullatore) Lb
f < 0, Li b f = Li
f -ú Lb fú
Sperimentalmente si
verifica che: Li
a f = Li b f .In generale: quali che
siano le trasformazioni adiabatiche reversibili e irreversibili che portino
il sistema da un generico stato i ad uno stato, altrettanto generico,
f, sperimentalmente si verifica che:
Li
a f = Li b f
È questo
un risultato empirico di notevole portata che, in termini più precisi viene
enunciato così:
Il lavoro
totale è lo stesso per tutti quei processi adiabatici fra due stati di equilibrio,
per i quali l'energia cinetica e potenziale non cambia.
Lif
è indipendente dal cammino del processo
Questo risultato
corrisponde al primo principio della termodinamica,che si esprime dicendo che:
in un qualsiasi
processo adiabatico fra due stati in cui l’energia cinetica e potenziale
dell'intero sistema non cambia, il lavoro adiabatico è indipendente dal cammino
percorso.
Energia
interna
Se il lavoro
speso per portare adiabaticamente un sistema termodinamico da uno stato di equilibrio
iniziale ad uno finale è lo stesso per tutti i percorsi che collegano i due
stati, vuol dire che: esiste
una funzione, U, delle coordinate termodinamiche del sistema il cui valore nello
stato finale meno il valore nello stato iniziale è uguale al lavoro adiabatico
compiuto.
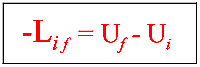
Una tale funzione prende il nome di Energia
Interna del sistema e costituisce una proprietà del sistema. Analogie:
Energia potenziale meccanica, energia potenziale elettrica.
Per trasformazioni infinitesime: -dLif = dU. dU è un differenziale
esatto in quanto U dipende dallo stato del sistema. Per trasformazioni finite:
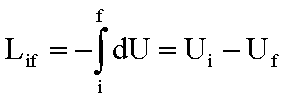
Formulazione
analitica del primo principio della termodinamica
Mettiamo
a confronto delle trasformazioni di sistemi che passano da uno stato di equilibrio
iniziale i ad
uno stato di equilibrio finale
f ; in
particolare confrontiamo il lavoro effettuato in trasformazioni adiabatiche
(Fig. 12 e 13), Li f ad,
con quello eseguito in trasformazioni adiabatiche, (Fig. 14 e 15), Li
f non ad.. L'esperienza
dimostra che: Li f non ad. ¹
Li f ad..
|
A)
Adiabatiche
Li f ad. = Ui - Uf
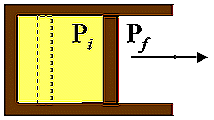
Fig. 12
|
B) Non
adiabatiche
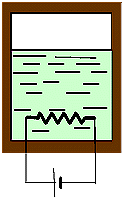 Fig.
13 Fig.
13
|
Li f ad. = Ui
- Uf
|
|
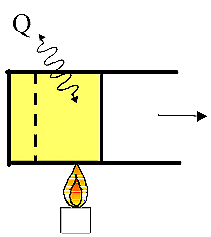 Fig.
14 Fig.
14
|
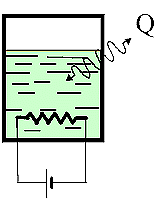 Fig.
15 Fig.
15
|
Li f non ad. ¹
Li f ad.
|
In un processo non adiabatico, cioè in un processo in cui il sistema interagisce
termicamente con l’ambiente, si verifica che:
Li
f non ad. ¹
Li f ad.
e del calore scorre
tra il sistema e l’ambiente. La differenza fra il lavoro non adiabatico,
L = Li f non ad, tra gli stati i ed f
ed il lavoro adiabatico, Li f ad.
, eseguito
tra gli stessi stati, si definisce flusso di calore Q:
Q = L
- Li f a
sostituendo -Li
f ad.= Uf - Ui
nella
relazione precedente, si ricava:

In
un qualsiasi processo in cui l’energia cinetica e potenziale di un sistema
non cambiano, l’aumento di energia interna del sistema è uguale al flusso
di calore ricevuto dal sistema meno il lavoro da esso eseguito.
La relazione
precedente è l'espressione analitica del primo principio della termodinamica.
Osserviamo che di fatto, però, detta equazione altro non è che la definizione
di flusso di calore.
Per piccoli flussi di
calore e lavoro, la variazione di energia interna del sistema è:
dU =
dQ
- dL
Nel caso
di una trasformazione
quasistatiche di
un sistema idrostatico il lavoro è esprimibile in termini delle coordinate termodinamiche
P e V ed è dato da d L = P dV , per cui:
dU =
dQ
- P dV
In generale nei processi reversibili in cui il sistema esegue vari lavori di
configurazione X dx:
dU = dQ
- S
Xdx
Il simbolo
d
in
dQ
viene usato per
ricordare che il calore dipende dal processo di trasferimento, come viene illustato
nel paragrafo segente; in altri termini il calore come il lavoro non è una funzione
di stato.La differenza, Q
- L, invece,
è una funzione di stato in quanto coincide con la variazione dell'energia interna
DU.
Il
calore dipende dal cammino della trasformazione
Come il lavoro anche
il calore dipende dal cammino percorso tra lo stato iniziale e finale di una
trasformazione. Consideriamo, per esempio i processi reversibili riportati nelle
Fig. 16 e 17; gli stati iniziali e finali, i
ed f
sono gli stessi per i due processi:
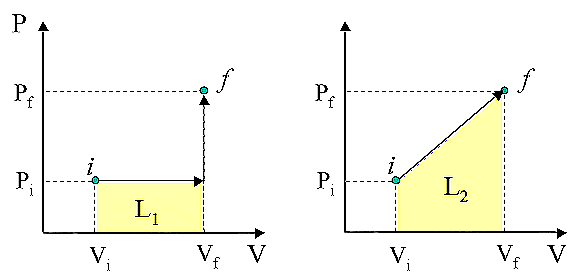
Fig. 16
Fig. 17
Applicando il primo principio
della termodinamica ai due casi, si trova, 1) Uf
- Ui = Q1 - L1 2) Uf
- Ui = Q2 - L2 , da cui:
|
Q1 - L1 = Q2 - L2 ; e,
dato che L1 ¹
L 2
|
Þ
Q1 ¹
Q2 |
Quindi anche il calore
non è una proprietà del sistema ma è funzione del cammino seguito nel processo.
E' per questo che un flusso infinitesimo di calore viene indicato con la lettera
d invece
che con la lettera d
riservata
a rappresentare differenziali di funzioni di stato
Calore
scambiato nei processi ciclici
Dal
primo principio della termodinamica,
DU = Uf
- Ui = Q - L. In un processo ciclico, stato iniziale e finale
coincidono, per cui la variazione di energia interna DU
= Uf - Ui è nulla in quanto U è funzione
di stato. Si ha allora che:
Q = L
Il flusso di calore
tra sistema e ambiente in un processo ciclico è uguale all’area del ciclo.
Il flusso di calore è positivo se il ciclo viene percorso in senso orario e
negativo se in senso antiorario
|
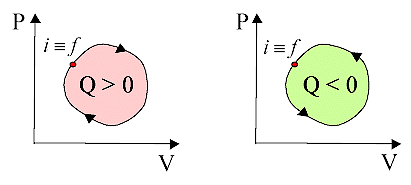
|
Il
flusso di calore tra sistema e ambiente in un processo ciclico è uguale,
in modulo all’area del ciclo.
|
Forma
generalizzata del primo principio della termodinamica
|
Fig. 18
|
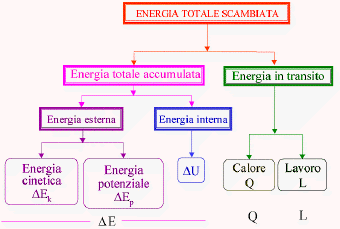
Fig. 19
|
La formulazione analitica del primo principio finora discussa, cioè,
DU
= Q - L
viene detta ristretta
in quanto non considera eventuali variazioni di energia cinetica DEk
e potenziale DEp
accumulata dall'intero sistema fra stato iniziale e finale di un processo.
La formulazione generale del primo principio tiene conto anche di queste
forme di energia; essa stabilisce che:
D
E = Q - L
dove DE
= DU + DEk
+ DEp
|

Fig. 20
|
Facciamo un esempio di applicazione della forma
generalizzzata del primo principio. Consideriamo il processo illustrato in Fig.
21.
|
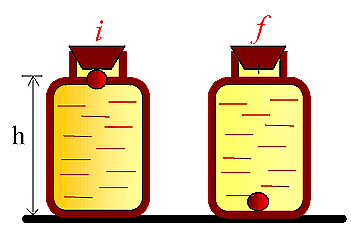 Fig.
21 Fig.
21
|
Sistema:
liquido
viscoso + biglia
Superficie
di contorno:
Parete isolante del contenitore
Processo:
la biglia,
inizialmente attaccata al tappo (statoi),
con un
dispendio di energia trascurabile, viene fatta
staccare. Essa cade lentamente sul fondo dove si ferma, (stato f
).
Processo
adiabatico Þ
Q = 0
Lavoro eseguito sull’ambiente: Þ
L = 0
DE
= Q - L = 0,
|
DE
= Ef - Ei = 0 Þ
Ef = Ei ; l’energia accumulata dal
sistema si conserva. Un termometro misurerebbe un leggero incremento della temperatura
del sistema olio-palla. Ricordando che DE
= DU
+ DEk
+ D
Ep = 0; poiché D
Ek = 0, e D
Ep = Epf - Epi = 0 - mgh = -mgh,
sostituendo in DE
si ha: 0 = D
U -mgh, per cui:
DU
> 0
L’energia potenziale
della biglia è convertita in energia interna del sistema.
 Fig.1
Fig.1
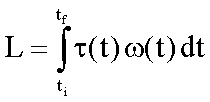
 Fig.
2
Fig.
2

 Fig.
3
Fig.
3
 Fig.
5
Fig.
5
 Fig.
7
Fig.
7
 Fig.
8
Fig.
8
 Fig.
9
Fig.
9
 Fig.
10
Fig.
10

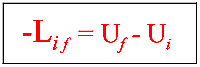
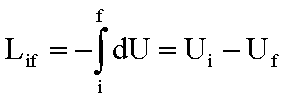
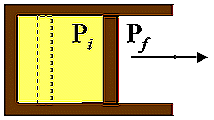
 Fig.
13
Fig.
13
 Fig.
14
Fig.
14
 Fig.
15
Fig.
15


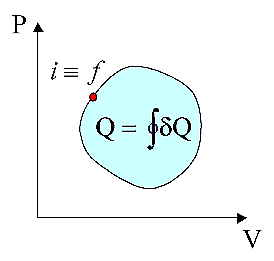
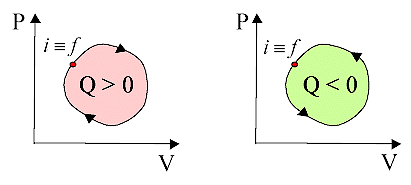



 Fig.
21
Fig.
21