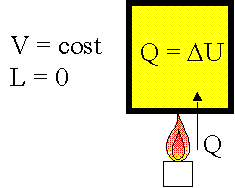
Fig. 1
Entalpia
Il calore assorbito a volume costante da un sistema idrostatico si trasforma integralmente in energia interna.
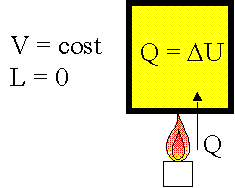
Fig. 1
Il calore trasferito a pressione costante ad un sistema idrostatico è:
|
dQ = dU + d L = dU + PdV = d(U +PV) = dH |
con H = U + PV |
Si definisce entalpia H l’energia trasferita a P = cost.
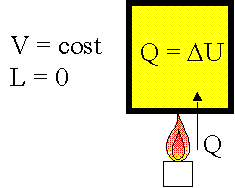
Fig. 2 Il calore assorbito a pressione
costante da un sistema idrostatico si trasforma in entalpia.
L’entalpia è una funzione di stato. Infatti, poiché U, P e V sono proprietà del sistema anche la loro somma è una proprietà del sistema. Il calore scambiato a P = cost. può essere espresso come: d Q = CpdT, dove Cp è il calore specifico molare a pressione costante. Si ha quindi che:
dH
= n CpdT
e
DH
= n Cp (Tf - Ti)
In natura moltissimi processi avvengono a P = cost. A seconda del processo, il calore scambiato prende il nome dal tipo di processo, ad es.: entalpia di transizione, di combustione,…
Entalpia di formazione
La variazione di entalpia che si ha nella formazione di un composto a partire dai suoi elementi prende il nome di entalpia di formazione.
Esempio: formazione del metano a partire dal carbonio (grafite) e dall’idrogeno
| C (sol.) + 2H2 (gas) à CH4 (gas) |
DHvap = -74.8 kJ/mole a 25°C |
Il segno negativo indica che nella combustione viene rilasciata energia. Questa energia viene fornita come calore per ogni mole di CH4 che viene prodotta.
Prima legge della
termodinamica e indipendenza dal cammino delle entalpie di reazione sono riassunte
nella legge di Hess che afferma:
In una reazione
l’entalpia totale è la somma delle entalpie dei singoli processi elementari
in cui la reazione può essere formalmente suddivisa.
Forme di entalpia
| L’entalpia si misura con un calorimetro a fiamma. Esistono vari tipi di entalpia: |
|
Entalpia di transizione |
Entalpia di atomizzazione |
entalpia di soluzione |
|
Entalpia di combustione |
Entalpia di neutralizzazione |
entalpia di legame |
|
Entalpia di formazione |
Entalpia di atomizzazione |
entalpia di reticolo |
|
Entalpia di reazione |
Entalpia di transizione |
............. |
Esempi
|
Entropia di transizione |
|
| H2O (liq.) + H2O (gas) | DHvap = + 40.7 kJ/mole (Vaporizzazione) |
| H2O (sol.) + H2O (liq.) | DHfus = + 6 kJ/mole (Liquefazione) |
|
Entalpia di combustione |
||
| CH4 (gas) + 2O2 (gas) + CO2 (gas) + 2H2O (liq.) |
|
DHcomb.
= - 890.4 kJ/mole a 1 atm e 25 °C.
Il segno negativo indica che nella combustione viene viene rilasciata energia . |
| C6H12O6 (sol.) + 6O2 (gas) + 6CO2 (gas) + 6H2O (liq.) |
|
DHcomb = - 2816 kJ/mol questa energia corrisponde a 15.6 kJ per g di glucosio |
Questa reazione è la sorgente di energia degli animali i quali usano la respirazione per sfruttare le risorse energetiche fornite dalla digestione e convertirle in attività metaboliche (attività cardiocircolatoria, respiratoria, di termoregolazione,...).
Altre forme di entalpia
Entalpia di reazione, è la variazione di entropia che si manifesta in una reazione chimica.
Entalpia di atomizzazione ( variazione di entropia conseguente alla decomposizione di una sostanza in un gas di atomi).
Si parla anche di entalpia di soluzione, entalpia di reticolo, entalpia di legame, entalpia di neutralizzazione di un acido da parte di una base, ....
Tutte queste forme di entalpia e la loro determinazione sono oggetto di studio della termodinamica chimica.
Entalpia di evaporazione dell’acqua e variazione di energia interna
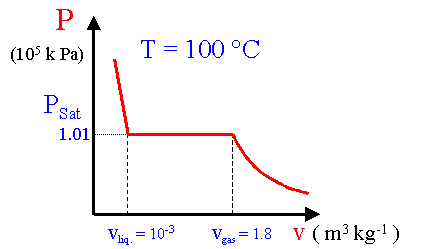
Per fare evaporare una data quantità di acqua di acqua a pressione ambiente e alla temperatura di 100 °C occorre fornire del calore. Quanta di questa energia è accumulata come energia interna? Quanta ne viene spesa come lavoro per fare spazio al vapore?
levap. = 22.6 x 105 J kg-1 Entalpia di evaporazione (= calore latente di evaporazione). .P = 1 atm = 1.01 x 105 Pa
|
Prima legge della termodinamica |
Du = levap - l |
|
Du = variazione di energia interna per unità di massa (specifica) |
l = lavoro per unità di massa (lavoro specifico) |
|
l = P (vgas - vliq.) = 1.01 x 105 (1.8 - 10-3) = 1.82 x 105 J. |
ugas - uliq. = l evap - l = 22.6 x 105 - 1.82 x 105 = 20.8 x 105 J
Nel processo di evaporazione si ha un aumento di energia interna pari a circa il 92 % del calore latente. L’energia restante è spesa come lavoro contro la pressione atmosferica per fare spazio al vapore.