Joule condusse l'esperimento di espansione libera di un gas a bassa pressione schematizzato in Fig. 1. Questo esperimento permise di stabilire che l'energia interna di un gas perfetto dipende solo dalla temperatura.
Sistema: gas ideale. Ambiente: bagno d’acqua.
Condizioni iniziali: Il gas è contenuto nel vano A; il vano B è sotto vuoto spinto. VA = VB
Processo: Espansione libera.
Risultato sperimentale:
![]()
|
|
|
Processo i à f Prima legge: Q - L = DU |
|
Q = 0, L = 0 |
Þ | DU = 0 ; Uf = Ui |
![]()
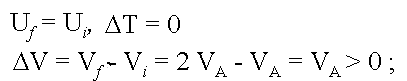
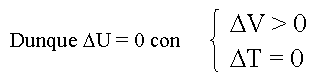
Considerando che l'energia interna è funzione dei parametri di stato indipendenti T e V, cioè U = U (T, V), ed osservando che una variazione di volume a T = cost non produce variazione di energia interna, si ha che questa dipende solo dalla temperatura:
U = U (T)
L’energia interna di un gas ideale dipende solo dalla T ed è indipendente dal volume.
Sia il risultato
sperimentale Tf = Ti
dell'espansione
libera di un gas a bassa densità,
che la conseguenza
sull'energia interna, U = U (T), sono corretti anche se l'esperimento di per
sè è fortemente criticabile. Infatti anche se si fosse verificata
una variazione di temperatura, difficilmente si sarebbe potuta rilevare a causa
della forte differenza di capacità termica tra il bagno di acqua ed il gas.
Joule mieté l'esperimento di espansione assieme a Thomson utilizzando un dispositivo
del tutto diverso (Fig. 1), vetrificando con più rigore la veridicità dei risultati
ottenuti per i gas ideali.
|
Fig. 1 |
Fig.2 |
Sistema: Un gas reale a pressione P1 e temperatura T1 è forzato ad attraversare un setto poroso. A causa dell’alta resistenza offerta dal setto al flusso di gas, a monte del setto il gas assume la pressione P2 < P1 e la temperatura T2.
Processo adiabatico: q = 0; le pareti del contenitore sono isolate. A causa del flusso continuo di gas, la grande capacità termica delle pareti non nasconde la variazione di temperatura tra monte e valle del setto.
lu = 0; nell’espansione il gas non fa lavoro.
Approssimazioni: le velocità iniziali e finali del gas sono piccole; i loro quadrati sono trascurabili. Le quote di ingresso ed uscita del fluido coincidono: z1 = z2 (Fig. 2).
A regime il flusso del gas è stazionario. Dall'equazione dell'efflusso stazionario
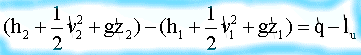
si deduce
che: il processo
è isoentalpico, h2 = h1.
Fissando P1
e T1 a monte del setto poroso si fissa il valore dell’entalpia
h1. Modificando la pressione a valle del setto, facendole assumere
i valori P2, P2’, P2’’,…
a P1 e T1 fissi, l’entalpia, a seguito dell’espansione,
non cambia: h1 = h2 = h2’ = h2’’
=….= cost. Il luogo dei punti sperimentali ad entalpia costante costituisce
la curva isoentalpica. Variando i valori di P1 e T1 si
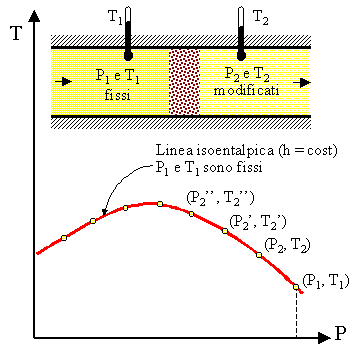
ottiene una famiglia di curve isoentalpiche (Fig.4).
|
Fig. 3 Curva isoentalpica. Lo stato 1, a monte del setto poroso, è caratterizzato dalla pressione P1 e dalla temperatura T1; gli stati 2, a valle del setto, si ottengono, a P1 e T1 fissi, cambiando la velocità di pompaggio in modo che la pressione assuma i valori P2, P2’, P2’’,….. a cui corrispondono le temperature T2, T2’, T2’’, ….. L’insieme dei punti sperimentali costituisce la curva ad h = cost. |
|
|
Fig. 4 Curve isoentalpiche (in rosso). Ciascuna di esse è stata ottenuta fissando la pressione e la temperatura a monte del setto e variando pressione a valle. La famiglia di curve si riferisce a diversi valori della pressione a monte del setto. Il luogo dei massimi delle curve isoentalpiche (curva tratteggiata blu) viene detta curva di inversione. (Le zone di raffreddamento e di riscaldamento sono discusse successivamente). |
A temperature abbastanza basse le curve isoentalpiche presentano un massimo, detto punto di inversione di Joule-Thomson, per il quale
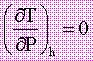
Nel punto di inversione, l’espansione, non produce nessuna variazione di temperatura.
Il luogo dei massimi forma la curva di inversione. Il coefficiente:
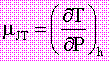
pendenza della curva isoentalpica, è detto coefficiente di Joule-Thomson; esso è una misura della variazione della temperatura al variare della pressione, ad entalpia costante.

Applicazione pratica: Liquefazione di gas
Il dispositivo a strozzatura di Joule-Thomson viene utilizzato per la liquefazione dei gas. Dalla Fig. 5 si può dedurre quando questo è possibile
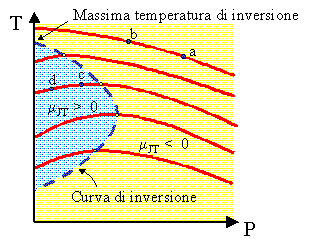
|
Fig.
5
Dalla Fig. 5 si osserva che: Espansione a-b:
m
JT < 0 il gas si riscalda
|
In Fig. 6 è illustrato lo schema di principio di un liquefattore di aria.
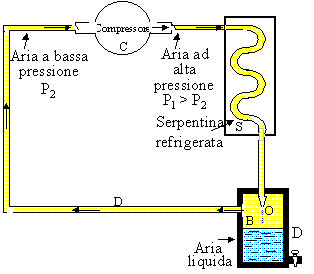
|
Fig. 6 L’aria esce ad alta pressione dal compressore (C), entra nella serpentina refrigerata (S) ed esce dal piccolo orifizio (O) ove ha luogo l’effetto Joule-Thomson. In B l’aria si raffredda e torna in ciclo attraverso il condotto (D) dove la pressione è mantenuta bassa dall’aspirazione del compressore. Di ciclo in ciclo la temperatura dell’aria in uscita da O si abbassa sino alla liquefazione dell’aria. L’aria liquida viene raccolta nel serbatoio (D). |