|
|
Sistema termodinamico = solido. A causa del calore scambiato
Q il volume del solido V cambia ma la sua variazione, Per il primo principio della termodinamica, Q - L = DU, si ha che: Q = DU e quindi, Q = U(Tf) - U(Ti) |
Energia interna di un solido
Calcoliamo l'energia interna di un solido. Supponiamo che esso scambi una quantità di calore Q con l'ambiente, a pressione P = costante.
|
|
Sistema termodinamico = solido. A causa del calore scambiato
Q il volume del solido V cambia ma la sua variazione, Per il primo principio della termodinamica, Q - L = DU, si ha che: Q = DU e quindi, Q = U(Tf) - U(Ti) |
dove Ti e Tf indicano rispettivamente la temperatura iniziale e finale del solido. Pe convenzione abbiamo assuto che se Q > 0 il solido assorbe calore dall'ambiente; ciò implica che
![]()
e di conseguenza aumenta la sua agitazione termica degli atomi che lo
costituiscono, mentre, se Q < 0 il solido cede calore all'ambiente
raffreddandosi e si riducendo così le vibrazioni degli atomi che lo costituiscono.
Pertanto, in prima approssimazione, l'energia interna di un solido dipende dalla sua
temperatura, cioè U = U(T).
Se consideriamo piccoli scambi di calore
dQ = dU.
Ricordiamo che, il calore scambiato per unità di massa e per unità di temperatura viene detto calore specifico del corpo:
![]()
dall'uguaglianza dQ = dU si ha pertanto che:
![]()
m rappresenta la massa del solido. Spesso, invece che parlare di calore per unità di massa si preferisce esprimere il calore per unità di mole n, il cosiddetto calore specifico molare, che si ottiene sostituendo nella stessa formula di c, m con n. Per i solidi, poichè U = U(T), ciò comporta che c dipende solamente da T, ne consegue che il calore specifico a volume costante, cV, è circa uguale al calore specifico a pressione costante, cP, (la differenza è solo di qualche percento), in sintesi:
cV = cV = c
Il calore specifico dei solidi si misura mediante appositi calorimetri. Sperimentalmente si trova che il calore specifico dipende dalla temperatura. Per piccoli intervalli di temperatura esso può essere ritenuto costante. Noto l'andamento del calore specifico dalla temperatura è possibile ricavare l'energia interna del solido: dalla relazione
|
|
si deduce che: | 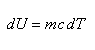 |
da cui, integrando tra la temperatura iniziale Ti e quella finale Tf si ha: |
e, nel caso in cui c(T) = cost, si trova:
|
|
Le prime misure di calori specifici eseguite su ristretti intervalli di temperatura mostrarono che, entro l'errore sperimentale, il calore molare di diversi solidi cresce con la temperatura asintoticamente al valore costante di circa 6 cal per mole e per grado (Fig. 2). Questi risultati sono ricordati con i nomi dei ricercatori che eseguirono le misure, Dulong e Petit (1819).
|
|
|
La legge di Dulong e Petit è verificata bene solo ad alte temperature. Questo risultato viene tuttora ricordato perchè accreditava la teoria classica dell'equiripartizione dell'energia, in quanto il valore di c = 6 cal/(mol K) corrisponde a 3 R, dove R è la costante universale dei gas (R =8.31 J/(mol K).