 |
Il risultato finale di
questi trasferimenti dovrebbe consistere nel fatto che la temperatura del compartimento
A |
IL PARADOSSO DEL DEMONIO DI MAXWELL
(Maxwell 1871)
 |
Il risultato finale di
questi trasferimenti dovrebbe consistere nel fatto che la temperatura del compartimento
A |
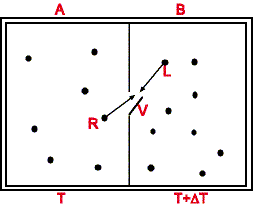
Ipotesi:
Le temperature iniziali nei due compartimenti sono leggermente diverse:
L' energia media delle molecole è ![]() .
.
Compartimento A
La molecola rapida R di energia ![]() entrando nel compartimento B cede l'energia -(
entrando nel compartimento B cede l'energia -(![]() )
al gas.
)
al gas.
La molecola lenta L nell'entrare con energia ![]() nel compartimento cede al gas in A l'energia
nel compartimento cede al gas in A l'energia ![]() .
.
Quindi ![]() .
.
Compartimento A
Arriva la molecola R da A con energia ![]() e parte la molecola L con energia
e parte la molecola L con energia ![]() .
.
Quindi ![]() .
.
La variazione totale di entropia del gas è:
![]()
Poiché ![]() sono tutte quantità maggiori di zero, si ha che
sono tutte quantità maggiori di zero, si ha che ![]() .
.
L'entropia del gas, e con essa quella dell'universo, aumenta!!
Ma il diavoletto per "vedere" le due molecole R ed L deve interagire
con esse, per esempio illuminandole con un fotone di energia ![]() almeno uguale all'eccesso o al difetto di energia e.
almeno uguale all'eccesso o al difetto di energia e.
Nel calcolo
dell'entropia dell'universo occorre tener conto quindi anche della variazione
di energia della lampada che illumina le due particelle e delle due particelle
che sono illuminate. Sia ![]() la temperatura del filamento della lampada e ed
la temperatura del filamento della lampada e ed ![]() l'energia di ciascuno dei due fotoni emessi per illuminare le due particelle R
ed L.
l'energia di ciascuno dei due fotoni emessi per illuminare le due particelle R
ed L.
Allora la variazione di entropia
del filamento per illuminare la molecola L risulta ![]() e la variazione di entropia del filamento per illuminare la molecola L
e la variazione di entropia del filamento per illuminare la molecola L ![]() .
.
La variazione di entropia della molecola R a seguito dell'acquisto di energia
del fotone è![]() . La molecola L quando è illuminata assorbe l'energia
. La molecola L quando è illuminata assorbe l'energia ![]() alla temperatura
alla temperatura ![]() ; la sua variazione di entropia nel processo di illuminazione è
; la sua variazione di entropia nel processo di illuminazione è
![]() .
.
La variazione di entropia del' universo nel processo di illuminazione è complessivamente:
![]()
![]()
La variazione totale di entropia dell'universo quindi risulta essere
![]()
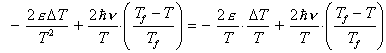
Dato che ![]() e che
e che ![]() , si
ha che
, si
ha che 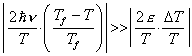 e quindi
e quindi ![]() .
.
Non si ha in questo modo alcuna contraddizione con il secondo principio
della termodinamica.
Riassumendo
Entra la molecola L ![]() L'energia aumenta di
L'energia aumenta di ![]() .
.
Entra la molecola R ![]() L'energia diminuisce di
L'energia diminuisce di ![]() .
.
Variazione di entropia del gas nell'ambiente A ![]() .
.
Entra la molecola R ![]() L'energia aumenta di
L'energia aumenta di ![]() .
.
Entra la molecola L ![]() L'energia diminuisce di
L'energia diminuisce di ![]() .
.
Variazione di entropia del gas nell'ambiente B ![]() .
.
Il filamento perde l'energia ![]() .
.
La molecola L acquista l'energia ![]() e si trasferisce in A
e si trasferisce in A![]() .
.
La molecola R acquista l'energia ![]() e si trasferisce in B
e si trasferisce in B![]() .
.
Quindi 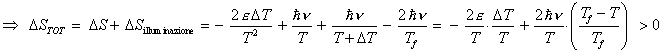 .
.