Le funzioni di stato sono associate a quantità fisiche che hanno
un valore individuato unicamente dallo stato termodinamico in cui
un dato sistema si trova. Siccome spesso avremo a che fare con sistemi
termodinamici a due gradi di libertà (ovvero sistemi in cui possiamo
scegliere il valore di al più due variabili, mentre tutte le altre
sono determinate dalle equazioni di stato), considereremo solo
funzioni di stato a due variabili. Data una funzione ![]() dipendente
dalle variabili
dipendente
dalle variabili ![]() ed
ed ![]() , una sua ``piccola variazione'' prende il
nome di differenziale (talvolta chiamato differenziale esatto, ma il
termine ``esatto'' è ovviamente ridondante):
, una sua ``piccola variazione'' prende il
nome di differenziale (talvolta chiamato differenziale esatto, ma il
termine ``esatto'' è ovviamente ridondante):
Siccome ![]() è una funzione di stato, un integrale di
è una funzione di stato, un integrale di ![]() dipende
unicamente dagli estremi di integrazione, non dal particolare cammino
dipende
unicamente dagli estremi di integrazione, non dal particolare cammino
![]() di integrazione scelto:
di integrazione scelto:
la catena di identità precedente è valida per qualunque cammino
![]() che conduce dallo stato iniziale
che conduce dallo stato iniziale ![]() (dove
(dove ![]() ,
, ![]() ed
ed ![]() assumono i valori
assumono i valori ![]() ,
, ![]() e
e ![]() ) allo stato finale
) allo stato finale ![]() (dove
(dove
![]() ,
, ![]() ed
ed ![]() assumono i valori
assumono i valori ![]() ,
, ![]() e
e ![]() ).
).
Non tutte le ``piccole'' quantità termodinamiche sono comunque differenziali esatti. Le due più importanti che non rientrano in questa categoria sono il calore ed il lavoro. Nè il calore nè il lavoro sono funzioni di stato o, se vogliamo, nè gli scambi infinitesimi di lavoro nè quelli di calore sono differenziali di funzioni di stato termodinamico.
Ne segue che in generale i loro integrali dipendono non solo dagli
stati iniziali e finali individuati da una certa trasformazione
reversibile, ma dalla particolare trasformazione (curva termodinamica)
![]() . Per rimarcare questo fatto chiameremo uno scambio infinitesimo
di lavoro
. Per rimarcare questo fatto chiameremo uno scambio infinitesimo
di lavoro ![]() e non
e non ![]() , poichè non esiste nessuna funzione
di stato
, poichè non esiste nessuna funzione
di stato ![]() . Allo stesso modo introdurremo il simbolo
. Allo stesso modo introdurremo il simbolo ![]() per
uno scambio infinitesimo di calore, invece di
per
uno scambio infinitesimo di calore, invece di ![]() .
.
Le quantità infinitesime ![]() ed
ed ![]() sono ``forme
differenziali'', ovvero funzioni integrabili lungo una curva
termodinamica
sono ``forme
differenziali'', ovvero funzioni integrabili lungo una curva
termodinamica ![]() (che corrisponde ad una certa trasformazione
revesibile), tali che il loro integrale rappresenta lo scambio
complessivo della quantità associata lungo la curva:
(che corrisponde ad una certa trasformazione
revesibile), tali che il loro integrale rappresenta lo scambio
complessivo della quantità associata lungo la curva:
Per i sistemi termodinamici semplici che considereremo nel seguito,
il lavoro è sempre una pressione moltiplicata per una variazione
di volume, quindi in pratica ![]() potrà sempre essere sostituito
dalla quantità
potrà sempre essere sostituito
dalla quantità ![]() (prendiamo il segno meno, intendendo
(prendiamo il segno meno, intendendo ![]() come il lavoro fatto dall'ambiente sul sistema, che è positivo quando
il volume diminuisce). Con la stessa convenzione,
come il lavoro fatto dall'ambiente sul sistema, che è positivo quando
il volume diminuisce). Con la stessa convenzione, ![]() sarà
il calore che fluisce dall'ambiente al sistema.
sarà
il calore che fluisce dall'ambiente al sistema.
Nonostante ![]() ed
ed ![]() non siano differenziali, la
prima legge della termodinamica afferma che una loro particolare
combinazione non dipende dalla trasformazione che il sistema subisce,
a patto che questa sia reversibile. Questa combinazione è dunque un
differenziale esatto; chiameremo il suo integrale
energia interna del sistema:
non siano differenziali, la
prima legge della termodinamica afferma che una loro particolare
combinazione non dipende dalla trasformazione che il sistema subisce,
a patto che questa sia reversibile. Questa combinazione è dunque un
differenziale esatto; chiameremo il suo integrale
energia interna del sistema:
Analogamente, il secondo principio della termodinamica per
trasformazioni reversibili può pure essere espresso dicendo che,
nonostante ![]() non sia un differenziale, il rapporto fra
non sia un differenziale, il rapporto fra ![]() e la temperatura
e la temperatura ![]() lo è. Si dice anche che
lo è. Si dice anche che ![]() è il
fattore integrante di
è il
fattore integrante di ![]() . Chiameremo entropia la funzione
di stato associata al differenziale che abbiamo trovato:
. Chiameremo entropia la funzione
di stato associata al differenziale che abbiamo trovato:
Nel seguito faremo uso del fatto che le funzioni di stato termodinamico
sono delle funzioni differenziabili. Ne segue che per le derivate seconde
l'ordine di derivazione può essere invertito senza che il risultato
cambi; questa proprietà puramente matematica prende il nome di
relazione di Schwarzt:
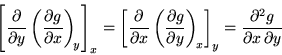
Prima di passare ad esaminare le proprietà delle principali funzioni
di stato, ricordiamo l'equazione di stato dei gas reali, detta anche
equazione di Van der Waals. In questa equazione il volume del gas è
sostituito da una sorta di ``volume efficace'' pari alla differenza fra
il volume ![]() del contenitore ed il volume proprio
del contenitore ed il volume proprio ![]() del gas. Inoltre,
la ``pressione efficace'' è aumentata rispetto alla pressione propria
di un termine
del gas. Inoltre,
la ``pressione efficace'' è aumentata rispetto alla pressione propria
di un termine ![]() che tiene conto degli urti fra le molecole del gas.
Ovviamente, l'equazione di Van der Waals si riduce all'equazione di
stato dei gas perfetti nel limite in cui i parametri
che tiene conto degli urti fra le molecole del gas.
Ovviamente, l'equazione di Van der Waals si riduce all'equazione di
stato dei gas perfetti nel limite in cui i parametri ![]() e
e ![]() vanno
a zero.
vanno
a zero.