La quantità
![]() , che come abbiamo visto è pari
all'energia cinetica media per molecola, ad una temperatura di
, che come abbiamo visto è pari
all'energia cinetica media per molecola, ad una temperatura di
![]() K vale circa
K vale circa ![]() meV. Questo ci permette di dare una stima
della velocità media delle molecole del gas:
meV. Questo ci permette di dare una stima
della velocità media delle molecole del gas:
dove ![]() è la massa molecolare (la massa di una mole).
Si noti che la ``velocità media'' è stata definita come
la radice quadrata di
è la massa molecolare (la massa di una mole).
Si noti che la ``velocità media'' è stata definita come
la radice quadrata di
![]() ovvero
ovvero
![]() ,
e non come
,
e non come
![]() , che è sempre nulla per l'ipotesi
sull'isotropia del gas. Per l'ossigeno alla temperatura di
, che è sempre nulla per l'ipotesi
sull'isotropia del gas. Per l'ossigeno alla temperatura di ![]() K,
ricordando che
K,
ricordando che
![]() Kg/mol, risulta:
Kg/mol, risulta:
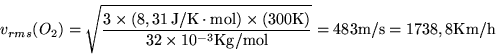
Ad una data temperatura i gas più leggeri hanno velocità più
alte, poichè ![]() dipende dall'inverso della radice di
dipende dall'inverso della radice di ![]() .
Per l'idrogeno (
.
Per l'idrogeno (![]() ), che è il gas più leggero di tutti,
a temperatura
), che è il gas più leggero di tutti,
a temperatura ![]() K abbiamo:
K abbiamo:
Queste velocità sono dello stesso ordine di grandezza delle
velocità del suono in questi gas alla stessa temperatura:
Questo non è sorprendente, dal momento che la velocità con cui una perturbazione si trasmette attraverso un gas è strettamente legata alla velocità delle sue molecole.