Abbiamo visto che il valore medio della velocità di una singola
molecola, intesa come quantità vettoriale, è zero, per l'ipotesi
di isotropia che abbiamo fatto sul gas perfetto. Naturalmente, il
valore medio del modulo della velocità non può essere zero, perchè
un modulo è una quantità sempre maggiore o uguale a zero. La
probabilità che una certa molecola abbia un valore ben determinato
per il modulo della velocità è stata calcolata da Maxwell, ed
è riassunta nella seguente formula (![]() è la massa molecolare e
è la massa molecolare e
![]() la costante di Boltzmann):
la costante di Boltzmann):
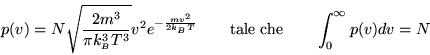
|
A partire da questa formula possono essere definiti vari
``valori medi'' per la velocità, tutti dello stesso ordine
di grandezza di
oppure la velocità media analitica, che è:
quindi
|
![\includegraphics[width=.95\linewidth]{maxwell.eps}](img92.png)
![\includegraphics[width=.95\linewidth]{maxwell2.eps}](img93.png)
|