Abbiamo visto che l'energia interna di un gas perfetto dipende solo dalla temperatura. L'indipendenza dell'energia interna dal volume occupato è dovuta al fatto che le interazioni fra le molecole sono considerate trascurabili.
L'energia interna di un gas reale dipende invece anche dal volume
occupato dal gas, cioè ![]() . Infatti, in un gas reale le
forze intermolecolari non sono trascurabili e perciò l'energia
interna oltre che cinetica è anche potenziale. Essa cioè
dipende dalla distanza intemolecolare e quindi dalla densità
e, di conseguenza, a parità di numero di molecole, dal volume
occupato.
. Infatti, in un gas reale le
forze intermolecolari non sono trascurabili e perciò l'energia
interna oltre che cinetica è anche potenziale. Essa cioè
dipende dalla distanza intemolecolare e quindi dalla densità
e, di conseguenza, a parità di numero di molecole, dal volume
occupato.
![\includegraphics[width=.8\linewidth]{eigasreal.eps}](img39.png)
Quali sono le variazioni sull'equazione di stato dovute alle
interazioni molecolari? Per ricavare una formula generale
ricorriamo al teorema del viriale per scrivere l'energia
cinetica totale del gas:
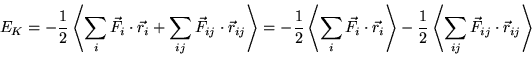
notiamo comunque che ora ![]() non coincide più necessariamente
con l'energia interna
non coincide più necessariamente
con l'energia interna ![]() , poichè le interazioni fra molecole
non sono più trascurabili. Nell'espressione precedente,
il primo termine è il contributo delle forze esterne (ovvero
le reazioni delle pareti del contenitore quando vengono colpite
dalle molecole), il secondo quello delle interazioni molecolari.
, poichè le interazioni fra molecole
non sono più trascurabili. Nell'espressione precedente,
il primo termine è il contributo delle forze esterne (ovvero
le reazioni delle pareti del contenitore quando vengono colpite
dalle molecole), il secondo quello delle interazioni molecolari.
Senza rifare tutto il calcolo, sostituiamo il termine dovuto alle
forze esterne con la sua manifestazione macroscopica (la pressione),
e l'energia cinetica totale con il teorema di equipartizione
dell'energia:
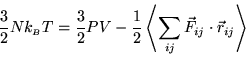
Semplificando, otteniamo una forma generale per l'equazione
di stato dei gas reali.
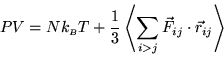
Il termine dipendente dalle ![]() dipende dalla natura delle
forze intermolecolari e quindi dalla natura del gas. Ovviamente, quando
queste forze possono essere trascurate ci riconduciamo all'equazione di
stato per il gas perfetto
dipende dalla natura delle
forze intermolecolari e quindi dalla natura del gas. Ovviamente, quando
queste forze possono essere trascurate ci riconduciamo all'equazione di
stato per il gas perfetto
![]() . Se, nello specifico, le forze di
interazione sono attrattive, allora i prodotti scalari sono negativi e
quindi la pressione del gas reale è minore che nel caso di gas perfetto.
. Se, nello specifico, le forze di
interazione sono attrattive, allora i prodotti scalari sono negativi e
quindi la pressione del gas reale è minore che nel caso di gas perfetto.
In pratica, il comportamento di un gas reale risulta molto ben
approssimato da una formula parametrica, la formula di Van der
Waals, che sostituisce il volume ![]() con il volume ``libero''
con il volume ``libero'' ![]() ,
e la pressione
,
e la pressione ![]() con una pressione efficace
con una pressione efficace
![]() .
I parametri
.
I parametri ![]() e
e ![]() dipendono, naturalmente, dalla natura del gas.
dipendono, naturalmente, dalla natura del gas.