Ricordiamo che la funzione entropia è il
differenziale esatto definito da:
dove
![]() è la forma differenziale ``calore'',
per una trasformazione reversibile. Sviluppiamo ora
è la forma differenziale ``calore'',
per una trasformazione reversibile. Sviluppiamo ora ![]() considerando
considerando
![]() come funzione di
come funzione di ![]() e
e ![]() e raccogliamo rispetto a
e raccogliamo rispetto a ![]() e
e ![]() :
:
Considerando anche ![]() una funzione di
una funzione di ![]() e
e ![]() ,
otteniamo per confronto diretto che:
,
otteniamo per confronto diretto che:
Applicando allora la relazione di Schwartz ricaviamo l'identità:
|
Infatti, la quantità di calore assorbita da un sistema in
una trasformazione infinitesima reversibile (area piccola
tratteggiata in figura) è
Il calore scambiato in una trasformazione reversibile |
![\includegraphics[width=.98\linewidth]{diagrammaTSgen.eps}](img77.png)
Trasformazione generale |
|
In una trasformazione isoterma la temperatura è costante.
In un diagramma |
![\includegraphics[width=.98\linewidth]{diagrammaTSisot.eps}](img79.png)
Trasformazione isoterma |
|
In una trasformazione adiabatica (detta anche isoentropica)
l'entropia è costante. In un diagramma |
![\includegraphics[width=.98\linewidth]{diagrammaTSadiab.eps}](img81.png)
Trasformazione adiabatica |
In una trasformazione isocora (cioè a volume costante) abbiamo:
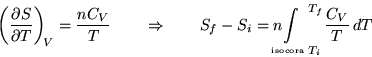
Questa relazione consente di calcolare la variazione di entropia
![\begin{displaymath}
\Delta S = S_f - S_i
= nC_V {{\int_{\makebox[0pt]{\textrm{...
...}}\quad}_{T_i}^{T_f} \frac{dT}{T}
= n C_V \ln\frac{T_f}{T_i}
\end{displaymath}](img85.png)
e la trasformazione corrispondente, nel piano |
![\includegraphics[width=.98\linewidth]{diagrammaTSisoc.eps}](img87.png)
Trasformazione isocora |