La funzione energia interna ![]() è una delle prime incontrate nello
studio della termodinamica. Ora vogliamo però studiare la sua
dipendenza dall'entropia. Combinando la prima e la seconda legge
della termodinamica per trasformazioni reversibili otteniamo:
è una delle prime incontrate nello
studio della termodinamica. Ora vogliamo però studiare la sua
dipendenza dall'entropia. Combinando la prima e la seconda legge
della termodinamica per trasformazioni reversibili otteniamo:
Considerando ![]() come una funzione di
come una funzione di ![]() ed
ed ![]() ,
otteniamo per confronto diretto che:
,
otteniamo per confronto diretto che:
Le derivate parziali di ![]() soddisfano la condizione di Schwartz:
soddisfano la condizione di Schwartz:
Questa relazione è la cosiddetta prima legge di Maxwell.
Utilizzando le precedenti espressioni è facile determinare
![]() e
e
![]() ; basta infatti eseguire una
misura di temperatura e una di pressione sul sistema. Come si determina
invece
; basta infatti eseguire una
misura di temperatura e una di pressione sul sistema. Come si determina
invece
![]() ?
In generale effettuare una misura di
?
In generale effettuare una misura di
![]() è difficile
perchè bisogna determinare di quanto varia l'energia interna in seguito
ad una variazione di volume mentre si somministra calore al sistema in
modo da mantenere costante la temperatura. Conviene pertanto
trovare una relazione che consenta di determinare sperimentalmente
è difficile
perchè bisogna determinare di quanto varia l'energia interna in seguito
ad una variazione di volume mentre si somministra calore al sistema in
modo da mantenere costante la temperatura. Conviene pertanto
trovare una relazione che consenta di determinare sperimentalmente
![]() in modo più semplice. Abbiamo già dimostrato
(vedere l'equazione 6) la seguente relazione:
in modo più semplice. Abbiamo già dimostrato
(vedere l'equazione 6) la seguente relazione:
![]() è facilmente misurabile perchè rappresenta
la variazione di pressione corrispondente ad una variazione di
temperatura quando il volume viene mantenuto costante. Per un gas
ideale la quantità
è facilmente misurabile perchè rappresenta
la variazione di pressione corrispondente ad una variazione di
temperatura quando il volume viene mantenuto costante. Per un gas
ideale la quantità
![]() si annulla esattamente:
si annulla esattamente:
Questo è il ben noto risultato che l'energia interna di un gas
perfetto è funzione della sola temperatura. In questo caso
possiamo scrivere semplicemente:
ma la variazione di energia interna a volume costante (senza lavoro
quindi) è la quantità di calore somministrata al sistema, dunque:
Questo risultato viene ricavato anche da considerazioni puramente
fenomenologiche (l'esperimento di Joule). Per un gas reale la
situazione è differente, poichè la pressione non dipende più
solo da ![]() . Consideriamo l'equazione di stato di Van
der Waals (vedere equazione 1):
. Consideriamo l'equazione di stato di Van
der Waals (vedere equazione 1):
quindi:
Vediamo allora che, in un gas reale, a temperatura costante,
all'aumentare del volume aumenta l'energia interna. Questo succede
perchè aumenta la distanza media intermolecolare, perciò occorre
fare un lavoro di allontanamento contro le forze di mutua attrazione
delle molecole. Possiamo ricavare la dipendenza di ![]() da
da ![]() integrando lungo una trasformazione isoterma:
integrando lungo una trasformazione isoterma:
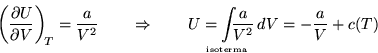
La costante di integrazione ![]() è indipendente da
è indipendente da ![]() ma può
ovviamente dipendere dalla temperatura dell'isoterma lungo la quale
abbiamo integrato. La possiamo valutare considerando la variazione
di
ma può
ovviamente dipendere dalla temperatura dell'isoterma lungo la quale
abbiamo integrato. La possiamo valutare considerando la variazione
di ![]() rispetto a
rispetto a ![]() , a
, a ![]() costante (che abbiamo già detto essere
il calore specifico
costante (che abbiamo già detto essere
il calore specifico ![]() ):
):
Dunque, per un gas reale, l'energia interna, oltre a dipendere dalla temperatura, dipende anche dal volume occupato dal gas.